Sujet SPECTROMÉTRIE DE MASSE - Septembre 1998

Temps conseillé : 50 minutes - 6 points
Le spectre suivant est celui d'un composé organique inconnu contenant du
carbone, de l'hydrogène, du chlore et de un atome d'oxygène par molécule.
Ce spectre a été obtenu par spectrométrie de masse par
bombardement électronique à 70eV. L'acquisition des ions n'a été faite qu'à
partir de m/z = 13. 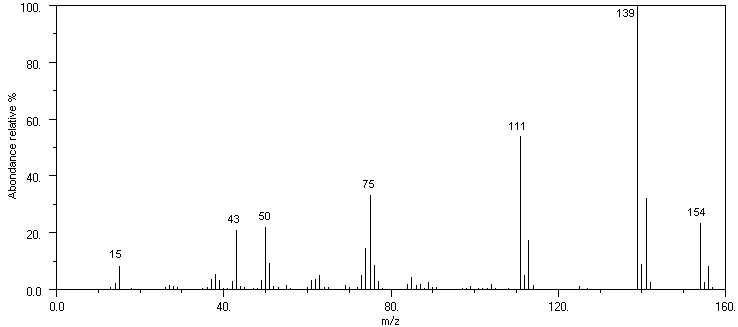
- Quelle est la composition isotopique naturelle du carbone ? de
l'hydrogène ? du chlore ? de l'oxygène ?
- Quel est le pic de base ?
- Quel est le pic moléculaire ?
- A partir des massifs des fragments, estimez le nombre d'atomes de Cl dans
la molécule.
- Bien qu'il ne soit pas visible sur le spectre présenté, un fragment à
m/z = 158 est présent en très faible abondance. Expliquez sa provenance.
- Sachant que l'abondance relative du pic à m/z=140 est de 7,7%, déduisez
le nombre d'atomes de carbone du fragment [139]+ puis celui de la
molécule.
- D'après l'énoncé et avec vos réponses aux questions précédentes,
faites les hypothèses pour déduire la formule brute.
- Calculez l'indice d'insaturation de la molécule.
- Expliquez comment l'ion s'est formé (perte de fragment à partir de la
molécule d'origine) pour tous les pics suivants : m/z = 154; 141; 139; 111;
43 ;15 ainsi que pour celui à m/z = 156.
Il n'est pas simple d'expliquer la présence des fragments à m/z = 50 et
75.
- Proposez des formules développées pour le composé inconnu.
- Expliquez l'absence de pic à m/z = 91 et m/z = 65.
- Donnez l'explication de vos formules, en les justifiant éventuellement
par l'application des règles de fragmentation.
- Parmi celles que vous avez proposées, quelle est la formule développée
qui vous semble la plus probable. Pourquoi retenez-vous une formule plutôt
qu'une autre ?
Documents joints : tables

Création : 7 septembre 1998, dernière mise à jour : 2000.