Soluté


Phase stationnaire  Phase mobile
Phase mobile
En chromatographie en phase gazeuse, le coefficient de partage est
fonction des interactions entre le soluté et la phase stationnaire,
Soluté  Phase stationnaire
Phase stationnaire
Facteur de Capacité k'
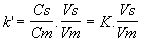
Équation 3
C'est le rapport de la quantité d'un même soluté, dans la phase
stationnaire et dans la phase mobile.
Vs : volume de phase stationnaire
Cs : concentration du soluté dans la phase stationnaire
Vm : volume de phase mobile ou volume mort
Cm : concentration du soluté dans la phase mobile
k' est aussi le rapport du temps passé par une espèce dans la phase
stationnaire sur le temps passé par cette même espèce dans la phase
mobile. k' peut être déterminé expérimentalement par l'équation
suivante :
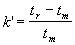
Équation 4
Notion d'efficacité
La largeur d'un pic est caractéristique de l'efficacité de la
séparation. L'efficacité est mesurée par le nombre de plateaux
théoriques Nth (par analogie avec la distillation) :
-
Plateaux théoriques
En Génie chimique, dans une colonne à distiller, on définit un
plateau théorique comme étant une portion de colonne d'où les 2
phases sortent en équilibre thermodynamique entre elles. Le nombre de
plateaux théoriques Nth représente l'efficacité de la colonne pour
chaque composé.
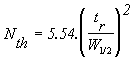
Équation 5
avec Nth : nombre de plateaux théoriques
tr : temps de rétention
W½ : largeur du pic à mi hauteur
-
Plateaux effectifs
Il est plus judicieux d'utiliser le nombre de plateaux effectifs
puisqu’il dépend vraiment du temps passé dans la phase stationnaire
:
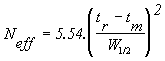
Equation 6
avec Neff : nombre de plateaux effectifs
tr : temps de rétention
tm : temps mort
W½ : largeur du pic à mi - hauteur
Neff et Nth sont sans dimension
- Hauteur Equivalente à un Plateau Théorique
Connaissant la longueur L de la colonne et le nombre de plateaux
théoriques Nth on définit une Hauteur Equivalente à un Plateau
Théorique (HEPT).
HEPT = L / Nth
Équation 7
La HEPT est fonction de différents paramètres qui eux-mêmes sont
susceptibles de varier avec la vitesse de la phase mobile. Ceci est
décrit par l'Équation 8. En conséquence, l'efficacité calculée par
les équations précédentes est fonction de la vitesse de la phase
mobile donc du débit.
-
Facteurs d'élargissement des pics
Une bonne colonne est capable de séparer des produits qui ont des
temps de rétention proches. Pour cela, le pic de chaque soluté doit
être le plus fin possible. Trois facteurs sont la cause de
l'élargissement des pics : la diffusion turbulente, la résistance au
transfert de masse et la diffusion longitudinale. Leur contribution (H)
est symbolisée par la relation suivante qui relie la hauteur
équivalente à un plateau théorique (HEPT) et la vitesse de la phase
mobile (u).
HEPT = f(u) = Hturbulente + Htransfert
de masse + Hlongitudinale
Équation 8 : hauteur équivalente à un plateau
théorique
Cette équation est la somme des facteurs suivants (Équation 9 à Équation
11).
-
La diffusion turbulente.
L'élargissement dû à la diffusion turbulente est expliqué par
le fait qu’il existe différents chemins parcourus par des
molécules d'une même sorte de soluté. La longueur des chemins
n'étant pas la même, elles ne mettent pas toutes le même temps pour
traverser la colonne ; le pic s'élargit. Ce phénomène est appelé
anisotropie d'écoulement et est symbolisé par la lettre A.
Hturbulente = A
Équation 9 : H turbulente
A est fonction de la nature des particules et de la régularité du
remplissage de la colonne.
-
La résistance au transfert de masse
L'élargissement s'explique aussi par l'accumulation de la phase
mobile dans les anfractuosités du support : les molécules qui
diffusent dans les poches de phase mobile vont moins vite que celles
qui n'y diffusent pas.
L'accumulation de la phase mobile est plus importante en milieu
liquide qu'en milieu gazeux. La résistance au transfert de masse y
est plus importante. Le soluté peut aussi diffuser à l'intérieur de
la phase stationnaire, ce qui réduit encore la vitesse d'échange et
nuit à l'efficacité.
Plus la vitesse de la phase mobile augmente, plus le phénomène de
résistance au transfert de masse nuit à l'efficacité.
Htransfert de masse = C.u
Équation 10 : H transfert de masse
C est une constante, u représente la vitesse de la phase mobile.
-
La diffusion longitudinale
Le coefficient de diffusion molaire est beaucoup plus faible en milieu
liquide qu'en milieu gazeux. Cette diffusion malgré tout existe. Elle
peut être comparée au mouvement brownien. Elle permet d'expliquer une
partie de l'élargissement des pics.
Hlongitudinale= B/u
Équation 11 : H longitudinale
Dans la pratique la diffusion longitudinale est négligeable à des
vitesses ordinaires de phase mobile en milieu liquide.
Qualité de la séparation
-
Sélectivité
On définit la sélectivité comme étant le rapport des temps de
rétentions réduits:
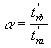
Équation 12
a est toujours > 1 car t'rb est >
t'ra
-
Résolution
Si dans certaines conditions, deux constituants sortent à des temps
proches, leurs pics risquent de se chevaucher. En optimisant les conditions
analytiques, il est possible d'améliorer l'allure du chromatogramme. Le
paramètre de résolution R quantifie la qualité de cette séparation.
Bien qu’on la mesure, en général sur 2 pics contigus, elle peut être
calculée sur n’importe quel couple de pics. Pour cela on trace les
tangentes aux points d’inflexion et la distance entre les intersections
avec la ligne de base correspond à la largeur du pic utilisée pour le
calcul.
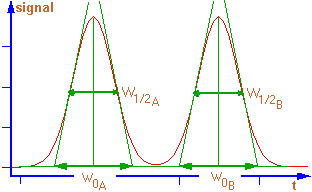
Figure 2: Deux pics de chromatogramme et tracé des
tangentes pour le calcul de la résolution .
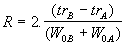 ou
ou 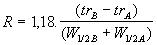
Équation 13
trA et trB : temps de rétention des 2 pics contigus.
W0 A et W0 B : largeur de ces pics à leur base.
W1/2A et W1/2B : largeur de ces pics à mi-hauteur.
si R < 1 mauvaise résolution
si 1 < R < 1,5 acceptable
si 1,4 < R < 1,6 optimale
si R > 1,6 trop bonne résolution (car le temps d'analyse est
rallongé).
Il est parfois utile d’exprimer la résolution en fonction de la
sélectivité et de l’efficacité du dernier des 2 pics intéressants.
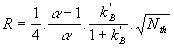 ou
ou 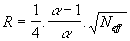
Équation 14

Création : 16 juin 1999, dernière mise à jour : 2001.