Chromatographie liquide basse pression
-
ère partie: chromatographie sur colonne d'alumine
La première séparation chromatographique date de 1903. Le botaniste russe
Michael Tswett réalisa une séparation de pigments végétaux par gravité,
sur une colonne remplie de carbonate de calcium avec de l'éther de pétrole.
Comme il s'agissait de séparer des pigments colorés, il nomma cette
technique chromatographie du grec "khrôma" couleur et "graphein"
écrire. Peut-être, joua-t-il sur les mots, car "tswet" signifie
couleur en russe.
La séparation sur colonne des colorants dérivés de l'anthraquinone est
comparable à celle réalisée en chromatographie sur couche mince.
-
Matériel
 | pompe péristaltique |
 | tuyaux et raccords |
 | colonne de verre avec réducteur de volume |
 | poudre d'aluminium oxyde neutre |
 | colorimètre avec cuve à circulation |
 | enregistreur |
 | éprouvettes graduées |
 | béchers |
 | mélange de colorants |
 | phase mobile : cyclohexane, toluène. |
Mode opératoire
-
Préparation de la colonne
La colonne est préparée d'avance. La poudre d'alumine est
imprégnée de phase mobile.
 | Rincez la colonne avec 20ml de cyclohexane. |
 | Arrêtez la pompe avant tout changement de liquide aspiré pour ne
pas introduire d'air dans le circuit. |
Enregistrement de la séparation.
 | Toute variation d'absorbance observée dans la cuve à circulation
dans le colorimètre est transmise à l'enregistreur. |
 | Réglez le blanc du colorimètre et le zéro de l'enregistreur
lorsque la cuve à circulation ne contient que du cyclohexane. |
 | Le déroulement de papier est de 10mm/min. Filtre électronique en
position C, Calibré. 10 x 100 (1000mV pleine échelle). |
Aspiration de l'échantillon et séparation
 | Aspirez directement dans le flacon le mélange de colorants
donné. |
 | Arrêtez la pompe. |
 | Aspirez 20 ml de cyclohexane afin d'entraîner le mélange en
tête de colonne et commencer l'élution. |
 | Arrêtez la pompe, observez |
 | Aspirez 75 ml d'un mélange 2/3 1/3 de toluène - cyclohexane afin
d'effectuer la séparation. |
 | Arrêtez la pompe. |
 | Aspirez environ 25 ml de cyclohexane afin de remettre la colonne
dans les conditions initiales. |
Observations et exploitation des résultats
 | Observez l'allure des tranches colorées dans la colonne après
passage de 20 ml de cyclohexane et après avoir aspirer 10 ml du
mélange toluène cyclohexane. |
 | Dessinez l'état d'avancement de la séparation dans les 2 cas. |
 | Observez l'enregistrement du signal. |
 | Déterminez le temps de rétention des composés du mélange. |
ème partie: Les résines échangeuses d'ions en analyse
quantitative
Un échangeur d'ions est un solide qui a la propriété éventuelle de
pouvoir échanger les ions qu'il contient avec d'autres ions provenant d'une
solution, par déplacement d'équilibre.
Pour accélérer les échanges et atteindre l'état d'équilibre en un
temps aussi court que possible, le solide doit être finement divisé afin de
présenter une surface de contact maximale avec la solution. Les échangeurs
d'ions sont donc généralement utilisés sous forme de grains très fins.
A l'origine, les premiers échangeurs d'ions étaient des zéolites
(composés naturels minéraux). Aujourd'hui, ce sont des composés organiques
de synthèse.
-
Emploi des résines en analyse
-
désionisation de l'eau
Une des applications les plus importantes et les plus anciennes
des résines échangeuses d'ions est la désionisation de l'eau
naturelle. Par passage sur des échangeurs de cations, les cations
de l'eau Ca2+, Mg2+ sont remplacés par des
protons H+. Par passage sur des échangeurs d'anions, les
anions de l'eau HCO3-, S042-
sont remplacée par des ions OH- qui, avec les ions H+
libérés, donnent de l'eau. Les deux types d'échangeurs peuvent
être employés simultanément. On obtient de l'eau bipermutée.
remplacement d'un ion par un autre
Les réactions d'échange permettent si elles sont quantitatives,
de remplacer le dosage de l'ion B+ par celui de l'ion C+
ou le dosage de l'ion D- par celui de l'ion E-.
Ainsi le dosage de cation (Na+, K+, NH4+...)
peut être remplacé par le dosage d'ions H+ par
protométrie, le dosage de l'anion SO42- peut
être remplacé par le dosage d'anions SCN- par
argentimétrie.
séparation de plusieurs ions
Les ions gênants peuvent être fixés par la résine pour que
l'effluent ne contienne que l'ion à doser.
Inversement, les ions à doser peuvent être fixés
sélectivement sur la colonne puis être récupérés séparément
par élution convenable comme en chromatographie classique.
Nature des résines échangeuses d'ions.
Une résine échangeuse d'ions est constituée d'un réseau
tridimensionnel de polymère de haute masse, le plus souvent du
polystyrène, sur lequel sont greffés des groupements fonctionnels
ionisés ou ionisables qui lui confèrent la propriété d'échangeurs
d'ions.
Il existe 2 catégories de résines:
 | les échangeurs de cations qui portent des groupements
fonctionnels anioniques tels que SO3- -COO--N-(CH2COO-)2 |
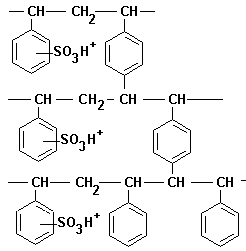
Figure 1 : Structure du réseau tridimensionnel de
styrène - divinylbenzène sulfoné
 | les échangeurs d'anions qui portent des groupements
fonctionnels cationiques tels que -+NR3 -+NR2H
>S+ |
Propriétés des résines en milieu aqueux
-
gonflement de la résine
Les résines sont pratiquement insolubles dans l'eau, mais le
réseau macromoléculaire étant poreux, l'eau peut pénétrer à
l'intérieur des grains et provoquer leur gonflement. Le gonflement
est susceptible de varier suivant le pH.
-
solvatation des groupements fonctionnels ionisables.
Considérons par exemple une résine sulfonique. Les anions SO3-
restent 1iés à la résine tandis que les protons sont libres de se
déplacer à l'intérieur du grain, les forces électrostatiques
entre ions de signes contraires les maintenant à l'intérieur du
grain.
Mécanisme de l'échange d'ions
Lorsqu'on met une résine échangeuse d'ions au contact d'un
électrolyte (par ex. solution de NaCl) il se produit principalement
le phénomène suivant :
Si l'ion "libre" ou libérable à l'intérieur de la
résine (par ex. H+) est différent de l'ion en solution
(par ex. Na+) qui possède la charge de même signe, des
échanges ont lieu entre ces deux ions (voir Figure 2) jusqu'à
l'établissement d'un état d'équilibre.
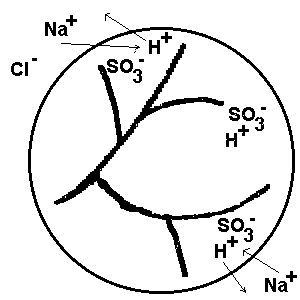
Figure 2 : échange (H+ + Na+)R
ó (H+ + Na+)S
(R et S symbolisent la résine et la solution).
Propriétés des échangeurs d'ions.
-
Capacité d'échange
C'est le nombre de groupements fonctionnels accessibles à
l'échange d'ion par unité de masse ou de volume d'échangeur. Elle
est exprimée en milliéquivalents (meq) par gramme de résine
sèche (ou par ml de résine humide). La résine Amberlite IRN 77 a
une capacité d'échange de 1,8 meq par ml de résine humide. Sa
teneur en humidité est de 55%.
-
Affinité d'une résine pour différents ions
Pour la plupart des résines du type polystyrène sulfoné
(cationiques fortes) l'ordre d'affinité croissante est le suivant
Li+ < H+ < Na+ < NH4+
Cd2+ < Mn2+ <
Mg2+ < Zn2+ < Cu2+
< Ca2+
L'affinité de la résine est d'autant plus grande que la charge
de l'ion est plus importante :
K+ < Ca2+ < Al3+
On remarquera qu'une résine cationique portant des ions H+
peut les échanger contre tous les autres cations sauf Li+.
Utilisation des résines échangeuses d'ions.
La résine doit être en grains très fins, de manière à offrir
une grande surface de contact tout en permettant un écoulement facile
du liquide.
La résine doit être intégralement mouillée (sans
emprisonner de bulles d'air). Pour cela la résine est mise en
contact quelques temps avec de l'eau. Le mélange eau - résine est
ensuite introduit dans la colonne portant à sa partie inférieure un
tampon de laine de verre ou une plaque perforée. La résine doit toujours
être entièrement immergée.
Il faut :
 | avant utilisation rincer la résine. |
 | après utilisation la régénérer si sa capacité d'échange
est dépassée. |

Création : 16 juin 1999, dernière mise à jour : 2001 |