Dosage de l'aspirine par
spectrophotométrie
Principe
L'aspirine (nom habituel de l'acide 2-acétoxybenzoïque ou
acide acétylsalicylique) donne par hydrolyse l'acide 2-hydroxybenzoïque (ou
acide ortho-hydroxybenzoïque ou acide salicylique) que l'on peut doser par
spectrophotométrie d'absorption dans l'ultraviolet.
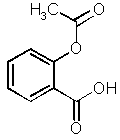
acide acétylsalicylique acide salicylique
Vous allez doser l'aspirine dans un médicament (Catalgine®). La forme
soluble dans l'eau de l'aspirine est un sel de sodium de l'acide organique en
présence de carbonate monosodique.
Après dissolution de l'échantillon, on passe en milieu acide pour chasser
le CO2. On évite ainsi la présence d'un milieu tampon qui rendrait
l'hydrolyse difficile. On passe ensuite en milieu basique pour l'hydrolyse.
Celle-ci se fait rapidement et quantitativement à la température ambiante dans
une solution de soude 0,2M. Le pH exact de la solution utilisée pour les
mesures d'absorbance n'est pas critique, parce que le coefficient d'absorbance
molaire et la longueur d'onde du maximum d'absorption ne varient pas dans le
domaine de pH allant de 6 à 12.
Partie expérimentale
Matériel
Appareil utilisé : spectrophotomètre UV Shimadzu
Solutions préparées d'avance :
 | Solution d'acide salicylique à environ 1 g.L-1; la
concentration exacte est indiquée sur le flacon. |
 | Solution aqueuse de NaOH à environ 0,2 M |
 | Solution aqueuse de HCl à environ 1 M |
Préparation de l'échantillon à doser
 | Videz entièrement un sachet de médicament dans un bécher de 150mL,
rincez les parois du sachet avec de l'eau distillée et dissoudre
l'échantillon dans environ 50 mL d'eau distillée. |
 | Transvasez quantitativement la solution dans une fiole jaugée de 100 mL
et complétez au volume avec de l'eau distillée. |
 | Mettez dans un bécher de 100 mL, 5 mL de la solution obtenue, ajoutez
lentement 1mL de d'HCl 1 M. Laissez agir pendant 10min en agitant le bécher
de temps à autre. |

Faites chacun une préparation !

 | Ajoutez ensuite à la préparation 10 mL de NaOH 0,2 M. Attendez 10 min en
agitant de temps en temps. |
 | Transvasez la solution quantitativement dans une fiole jaugée de 100 mL
et ajustez au trait de jauge avec de l'eau distillée. |
Préparation des solutions étalons
Vous disposez de fioles jaugées et pipettes graduées. Préparez dans des
fioles de 100mL, 5 solutions étalons 10mg.L-1, 30mg.L-1,
50mg.L-1, 70mg.L-1 et 100mg.L-1 en acide
salicylique. Ajoutez dans chaque fiole jaugée 1,0mL de soude 0,2M (c'est la
forme basique de l'acide salicylique qui est soluble) et complétez à 100 mL
avec de l'eau distillée.
Spectre d'absorption
Utilisez des cuves de 1cm de trajet optique en quartz. Enregistrez le spectre
d'absorption dans l'U.V. de la solution à 50mg.L-1. Choisissez alors
la longueur d'onde correspondant au maximum d'absorption par rapport à l'eau
distillée comme référence.
Mesures
|
fiole |
mL de solution d'acide salicylique à 1g/L |
concentration g/L |
Absorbance |
|
1 |
- |
- |
- |
|
2 |
- |
- |
- |
|
3 |
- |
- |
- |
|
4 |
- |
- |
- |
|
5 |
- |
- |
- |
|
préparation A |
- |
- |
- |
|
préparation B |
- |
- |
- |
 | Utilisez la courbe d'étalonnage pour calculer la concentration en acide
salicylique. On calculera ensuite la masse d'acide acétylsalicylique qui se
trouvait dans le sachet de médicament. |
Conclusions et rapport
Dans votre compte rendu, vous devrez noter au moins :
 | vos commentaires sur la validité de la loi de Beer - Lambert, |
 | le choix de la longueur d'onde de travail, |
 | les concentrations de vos solutions, |
 | le tracé de la courbe d'étalonnage, |
 | le calcul de la concentration de l'échantillon à doser en acide
salicylique, |
 | bien évidemment vous devrez indiquer la quantité dosée d'aspirine
contenue dans le sachet. |

Création : 26 janvier 1998, dernière mise à jour : 2000.
|